V oblasti modernej medicíny sa antibiotiká ukázali ako jeden z najvýznamnejších pokrokov, dramaticky znižujúci výskyt a úmrtnosť spojenú s mikrobiálnymi infekciami. Ich schopnosť zmeniť klinické výsledky bakteriálnych infekcií predĺžila priemernú dĺžku života nespočetného množstva pacientov. Antibiotiká sú kľúčové pri zložitých lekárskych zákrokoch vrátane chirurgických zákrokov, implantácií, transplantácií a chemoterapie. Výskyt patogénov rezistentných na antibiotiká je však rastúcim problémom, ktorý časom znižuje účinnosť týchto liekov. Prípady rezistencie na antibiotiká boli zdokumentované vo všetkých kategóriách antibiotík, keďže dochádza k mikrobiálnym mutáciám. Selekčný tlak vyvíjaný antimikrobiálnymi liekmi prispel k nárastu rezistentných kmeňov, čo predstavuje významnú výzvu pre globálne zdravie.
Na boj proti naliehavému problému antimikrobiálnej rezistencie je nevyhnutné zaviesť účinné politiky kontroly infekcií, ktoré obmedzia šírenie rezistentných patogénov a zároveň znížia používanie antibiotík. Okrem toho existuje naliehavá potreba alternatívnych liečebných metód. Hyperbarická kyslíková terapia (HBOT) sa v tejto súvislosti ukázala ako sľubná metóda, ktorá zahŕňa inhaláciu 100 % kyslíka pri špecifických úrovniach tlaku počas určitého časového obdobia. HBOT, ktorá sa používa ako primárna alebo doplnková liečba infekcií, môže ponúknuť novú nádej v liečbe akútnych infekcií spôsobených patogénmi rezistentnými na antibiotiká.
Táto terapia sa čoraz viac používa ako primárna alebo alternatívna liečba rôznych stavov vrátane zápalu, otravy oxidom uhoľnatým, chronických rán, ischemických chorôb a infekcií. Klinické využitie HBOT pri liečbe infekcií je rozsiahle a pacientom poskytuje neoceniteľné výhody.

Klinické aplikácie hyperbarickej kyslíkovej terapie pri infekcii
Súčasné dôkazy jednoznačne podporujú aplikáciu HBOT, a to ako samostatnej, tak aj doplnkovej liečby, čo predstavuje významný prínos pre infikovaných pacientov. Počas HBOT sa tlak kyslíka v arteriálnej krvi môže zvýšiť na 2000 mmHg a výsledný vysoký gradient tlaku kyslíka v tkanive môže zvýšiť hladinu kyslíka v tkanive na 500 mmHg. Takéto účinky sú obzvlášť cenné pri podpore hojenia zápalových reakcií a porúch mikrocirkulácie pozorovaných v ischemickom prostredí, ako aj pri zvládaní kompartmentového syndrómu.
HBOT môže tiež ovplyvniť stavy závislé od imunitného systému. Výskum naznačuje, že HBOT môže potlačiť autoimunitné syndrómy a antigénom indukované imunitné reakcie, čím pomáha udržiavať toleranciu štepu znížením cirkulácie lymfocytov a leukocytov a zároveň moduláciou imunitných reakcií. Okrem toho HBOTpodporuje hojeniepri chronických kožných léziách stimuláciou angiogenézy, čo je kľúčový proces pre lepšie hojenie. Táto terapia tiež podporuje tvorbu kolagénovej matrice, čo je nevyhnutná fáza hojenia rán.
Osobitnú pozornosť treba venovať určitým infekciám, najmä hlbokým a ťažko liečiteľným infekciám, ako je nekrotizujúca fasciitída, osteomyelitída, chronické infekcie mäkkých tkanív a infekčná endokarditída. Jedným z najbežnejších klinických aplikácií HBOT sú infekcie kože a mäkkých tkanív a osteomyelitída spojená s nízkou hladinou kyslíka, ktoré sú často spôsobené anaeróbnymi alebo rezistentnými baktériami.
1. Infekcie diabetickej nohy
Diabetická nohaVredy sú rozšírenou komplikáciou u diabetických pacientov a postihujú až 25 % tejto populácie. V týchto vredoch často vznikajú infekcie (predstavujú 40 % – 80 % prípadov) a vedú k zvýšenej chorobnosti a úmrtnosti. Infekcie diabetickej nohy (DFI) zvyčajne pozostávajú z polymikrobiálnych infekcií s rôznymi identifikovanými anaeróbnymi bakteriálnymi patogénmi. Rôzne faktory, vrátane porúch funkcie fibroblastov, problémov s tvorbou kolagénu, bunkových imunitných mechanizmov a funkcie fagocytov, môžu brániť hojeniu rán u diabetických pacientov. Niekoľko štúdií identifikovalo zhoršenú oxygenáciu kože ako silný rizikový faktor amputácií súvisiacich s DFI.
Ako jedna zo súčasných možností liečby DFIBolo hlásené, že HBOT významne zlepšuje mieru hojenia vredov na diabetickej nohe, čím sa znižuje potreba amputácií a komplikovaných chirurgických zákrokov. Nielenže minimalizuje potrebu náročných zákrokov, ako sú lalokové operácie a štepenie kože, ale v porovnaní s chirurgickými možnosťami predstavuje aj nižšie náklady a minimálne vedľajšie účinky. Štúdia Chena a kol. preukázala, že viac ako 10 sedení HBOT viedlo k 78,3 % zlepšeniu miery hojenia rán u diabetických pacientov.
2. Nekrotizujúce infekcie mäkkých tkanív
Nekrotizujúce infekcie mäkkých tkanív (NSTI) sú často polymikrobiálne, typicky vznikajú kombináciou aeróbnych a anaeróbnych bakteriálnych patogénov a často sú spojené s tvorbou plynu. Hoci sú NSTI relatívne zriedkavé, vykazujú vysokú úmrtnosť kvôli ich rýchlemu postupu. Včasná a vhodná diagnóza a liečba sú kľúčom k dosiahnutiu priaznivých výsledkov a HBOT sa odporúča ako doplnková metóda na liečbu NSTI. Hoci pretrvávajú spory ohľadom použitia HBOT pri NSTI kvôli nedostatku prospektívnych kontrolovaných štúdií,dôkazy naznačujú, že to môže súvisieť so zlepšenou mierou prežitia a zachovaním orgánov u pacientov s NSTIRetrospektívna štúdia preukázala významné zníženie úmrtnosti u pacientov s NSTI, ktorí dostávali HBOT.
1.3 Infekcie v mieste chirurgického zákroku
Infekcie operačného strediska (SSI) možno klasifikovať na základe anatomického miesta infekcie a môžu vznikať z rôznych patogénov vrátane aeróbnych aj anaeróbnych baktérií. Napriek pokroku v opatreniach na kontrolu infekcií, ako sú sterilizačné techniky, používanie profylaktických antibiotík a zlepšenie chirurgických postupov, SSI zostávajú pretrvávajúcou komplikáciou.
Jedna významná štúdia skúmala účinnosť HBOT v prevencii hlbokých SSI pri operáciách neuromuskulárnej skoliózy. Predoperačná HBOT môže významne znížiť výskyt SSI a uľahčiť hojenie rán. Táto neinvazívna terapia vytvára prostredie, v ktorom sú hladiny kyslíka v tkanivách rany zvýšené, čo sa spája s oxidačným ničivým účinkom proti patogénom. Okrem toho rieši znížené hladiny kyslíka v krvi, ktoré prispievajú k rozvoju SSI. Okrem iných stratégií kontroly infekcií sa HBOT odporúča najmä pri operáciách s čistou kontamináciou, ako sú kolorektálne zákroky.
1.4 Popáleniny
Popáleniny sú zranenia spôsobené extrémnym teplom, elektrickým prúdom, chemikáliami alebo žiarením a môžu predstavovať vysokú mieru chorobnosti a úmrtnosti. HBOT je prospešná pri liečbe popálenín zvýšením hladiny kyslíka v poškodených tkanivách. Zatiaľ čo štúdie na zvieratách a klinické štúdie prinášajú zmiešané výsledky týkajúce saúčinnosť HBOT pri liečbe popálenínŠtúdia zahŕňajúca 125 pacientov s popáleninami ukázala, že HBOT nepreukázala významný vplyv na úmrtnosť ani na počet vykonaných operácií, ale skrátila priemerný čas hojenia (19,7 dňa v porovnaní so 43,8 dňami). Integrácia HBOT s komplexnou liečbou popálenín by mohla účinne kontrolovať sepsu u pacientov s popáleninami, čo by viedlo k kratšiemu času hojenia a zníženiu potreby tekutín. Na potvrdenie úlohy HBOT pri liečbe rozsiahlych popálenín je však potrebný ďalší rozsiahly prospektívny výskum.
1.5 Osteomyelitída
Osteomyelitída je infekcia kosti alebo kostnej drene, často spôsobená bakteriálnymi patogénmi. Liečba osteomyelitídy môže byť náročná kvôli relatívne slabému prekrveniu kostí a obmedzenému prenikaniu antibiotík do drene. Chronická osteomyelitída sa vyznačuje pretrvávajúcimi patogénmi, miernym zápalom a nekrotickou tvorbou kostného tkaniva. Refraktérna osteomyelitída označuje chronické infekcie kostí, ktoré pretrvávajú alebo sa opakujú napriek vhodnej liečbe.
Ukázalo sa, že HBOT významne zlepšuje hladinu kyslíka v infikovaných kostných tkanivách. Početné kazuistiky a kohortové štúdie naznačujú, že HBOT zlepšuje klinické výsledky u pacientov s osteomyelitídou. Zdá sa, že účinkuje prostredníctvom rôznych mechanizmov vrátane zvýšenia metabolickej aktivity, potlačenia bakteriálnych patogénov, zosilnenia antibiotických účinkov, minimalizácie zápalu a podpory hojenia.procesy. Po HBOT vykazuje 60 % až 85 % pacientov s chronickou, refraktérnou osteomyelitídou známky potlačenia infekcie.
1.6 Plesňové infekcie
Celosvetovo viac ako tri milióny ľudí trpí chronickými alebo invazívnymi plesňovými infekciami, čo vedie k viac ako 600 000 úmrtiam ročne. Výsledky liečby plesňových infekcií sú často ohrozené faktormi, ako je zmenený imunitný stav, základné ochorenia a charakteristiky virulencie patogénov. HBOT sa stáva atraktívnou terapeutickou možnosťou pri závažných plesňových infekciách vďaka svojej bezpečnosti a neinvazívnej povahe. Štúdie naznačujú, že HBOT by mohla byť účinná proti plesňovým patogénom, ako sú Aspergillus a Mycobacterium tuberculosis.
HBOT podporuje antifungálne účinky inhibíciou tvorby biofilmu u Aspergillus, pričom zvýšená účinnosť sa pozoruje u kmeňov bez génov superoxiddismutázy (SOD). Hypoxické podmienky počas plesňových infekcií predstavujú výzvu pre dodávanie antifungálnych liekov, čo robí zvýšené hladiny kyslíka z HBOT potenciálne prospešným zásahom, hoci je potrebný ďalší výskum.
Antimikrobiálne vlastnosti HBOT
Hyperoxické prostredie vytvorené HBOT iniciuje fyziologické a biochemické zmeny, ktoré stimulujú antibakteriálne vlastnosti, vďaka čomu je účinnou doplnkovou terapiou infekcie. HBOT vykazuje pozoruhodné účinky proti aeróbnym baktériám a prevažne anaeróbnym baktériám prostredníctvom mechanizmov, ako je priama baktericídna aktivita, posilnenie imunitných odpovedí a synergické účinky so špecifickými antimikrobiálnymi látkami.
2.1 Priame antibakteriálne účinky HBOT
Priamy antibakteriálny účinok HBOT sa do značnej miery pripisuje tvorbe reaktívnych foriem kyslíka (ROS), medzi ktoré patria superoxidové anióny, peroxid vodíka, hydroxylové radikály a hydroxylové ióny – všetky vznikajú počas bunkového metabolizmu.
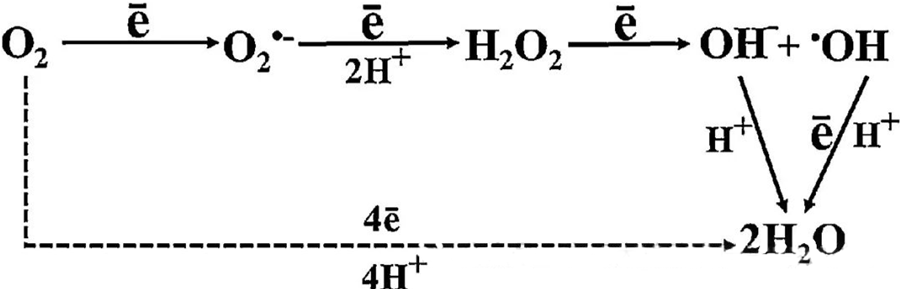
Interakcia medzi O₂ a bunkovými zložkami je nevyhnutná pre pochopenie toho, ako sa ROS tvoria v bunkách. Za určitých podmienok označovaných ako oxidačný stres je narušená rovnováha medzi tvorbou ROS a ich degradáciou, čo vedie k zvýšeným hladinám ROS v bunkách. Produkciu superoxidu (O₂⁻) katalyzuje superoxiddismutáza, ktorá následne premieňa O₂⁻ na peroxid vodíka (H₂O₂). Táto premena je ďalej zosilnená Fentonovou reakciou, ktorá oxiduje Fe²⁺ za vzniku hydroxylových radikálov (·OH) a Fe³⁺, čím sa iniciuje škodlivá redoxná sekvencia tvorby ROS a poškodenia buniek.
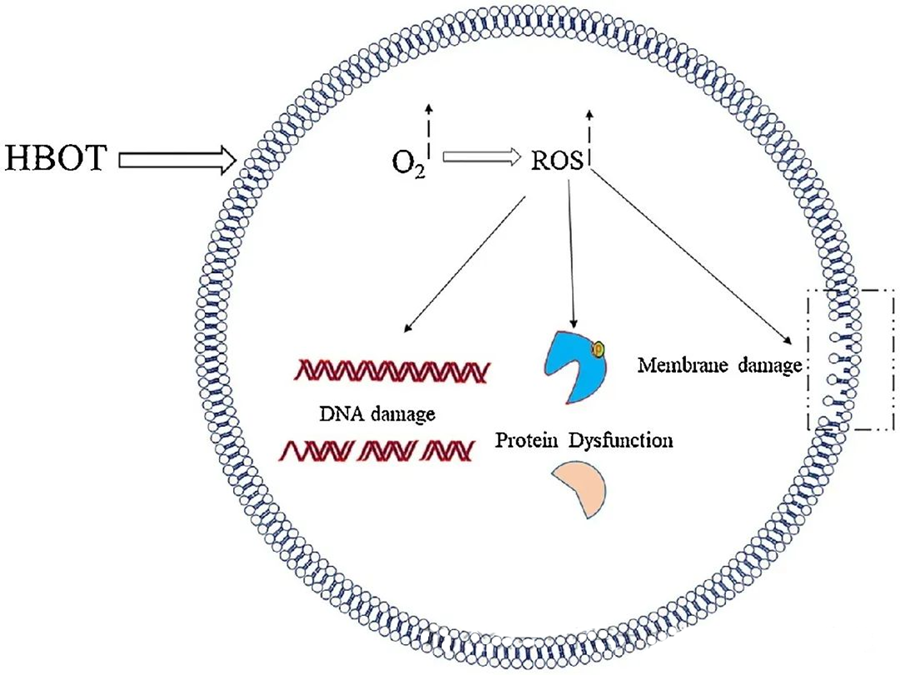
Toxické účinky ROS sú zamerané na kritické bunkové komponenty, ako sú DNA, RNA, proteíny a lipidy. DNA je primárnym cieľom cytotoxicity sprostredkovanej H₂O₂, pretože narúša deoxyribózové štruktúry a poškodzuje základné zloženie. Fyzikálne poškodenie spôsobené ROS sa rozširuje aj na špirálovú štruktúru DNA, čo môže byť dôsledkom peroxidácie lipidov spustenej ROS. To podčiarkuje nepriaznivé dôsledky zvýšených hladín ROS v biologických systémoch.
Antimikrobiálny účinok ROS
ROS zohrávajú dôležitú úlohu pri inhibícii mikrobiálneho rastu, ako sa preukázalo prostredníctvom tvorby ROS indukovanej HBOT. Toxické účinky ROS priamo pôsobia na bunkové zložky, ako je DNA, proteíny a lipidy. Vysoké koncentrácie aktívnych foriem kyslíka môžu priamo poškodiť lipidy, čo vedie k peroxidácii lipidov. Tento proces narúša integritu bunkových membrán a následne funkčnosť membránovo asociovaných receptorov a proteínov.
Okrem toho proteíny, ktoré sú tiež významnými molekulárnymi cieľmi ROS, podliehajú špecifickým oxidačným modifikáciám na rôznych aminokyselinových zvyškoch, ako je cysteín, metionín, tyrozín, fenylalanín a tryptofán. Napríklad sa ukázalo, že HBOT indukuje oxidačné zmeny v niekoľkých proteínoch v E. coli, vrátane elongačného faktora G a DnaK, čím ovplyvňuje ich bunkové funkcie.
Posilnenie imunity pomocou HBOT
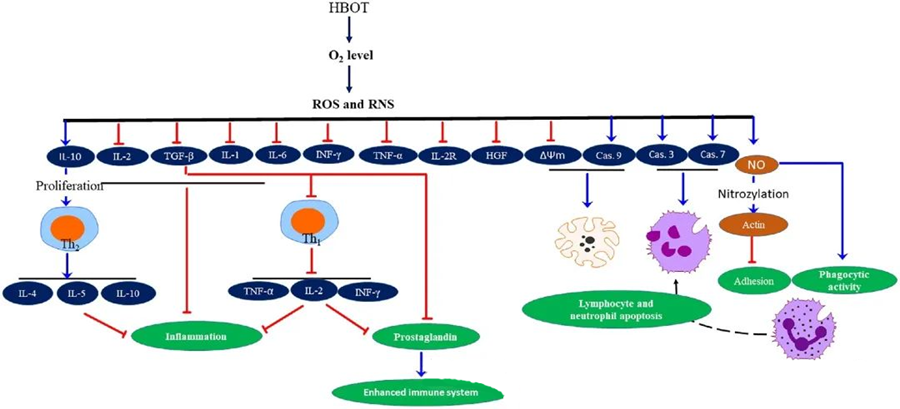
Protizápalové vlastnosti HBOTboli zdokumentované a ukázali sa ako kľúčové pre zmiernenie poškodenia tkaniva a potlačenie progresie infekcie. HBOT významne ovplyvňuje expresiu cytokínov a iných zápalových regulátorov, čím ovplyvňuje imunitnú odpoveď. Rôzne experimentálne systémy pozorovali rozdielne zmeny v génovej expresii a tvorbe proteínov po HBOT, ktoré buď zvyšujú, alebo znižujú reguláciu rastových faktorov a cytokínov.
Počas procesu HBOT zvýšené hladiny O₂ spúšťajú celý rad bunkových reakcií, ako je potlačenie uvoľňovania prozápalových mediátorov a podpora apoptózy lymfocytov a neutrofilov. Tieto účinky spoločne posilňujú antimikrobiálne mechanizmy imunitného systému, čím uľahčujú hojenie infekcií.
Štúdie ďalej naznačujú, že zvýšené hladiny O₂ počas HBOT môžu znížiť expresiu prozápalových cytokínov vrátane interferónu-gama (IFN-γ), interleukínu-1 (IL-1) a interleukínu-6 (IL-6). Tieto zmeny zahŕňajú aj zníženie pomeru CD4:CD8 T buniek a moduláciu iných rozpustných receptorov, čo v konečnom dôsledku zvyšuje hladiny interleukínu-10 (IL-10), ktorý je kľúčový pre potlačenie zápalu a podporu hojenia.
Antimikrobiálne účinky HBOT sú prepojené so zložitými biologickými mechanizmami. Bolo hlásené, že superoxid aj zvýšený tlak nekonzistentne podporujú antibakteriálnu aktivitu a apoptózu neutrofilov indukovanú HBOT. Po HBOT výrazné zvýšenie hladiny kyslíka zvyšuje baktericídne schopnosti neutrofilov, čo je základná zložka imunitnej odpovede. Okrem toho HBOT potláča adhéziu neutrofilov, ktorá je sprostredkovaná interakciou β-integrínov na neutrofiloch s molekulami medzibunkovej adhézie (ICAM) na endotelových bunkách. HBOT inhibuje aktivitu neutrofilného β-2 integrínu (Mac-1, CD11b/CD18) prostredníctvom procesu sprostredkovaného oxidom dusnatým (NO), čo prispieva k migrácii neutrofilov do miesta infekcie.
Presné preskupenie cytoskeletu je nevyhnutné pre neutrofily, aby mohli účinne fagocytovať patogény. Ukázalo sa, že S-nitrosylácia aktínu stimuluje polymerizáciu aktínu, čo potenciálne uľahčuje fagocytárnu aktivitu neutrofilov po predliečbe HBOT. Okrem toho HBOT podporuje apoptózu v ľudských T-bunkových líniách prostredníctvom mitochondriálnych dráh, pričom po HBOT bola hlásená zrýchlená smrť lymfocytov. Blokovanie kaspázy-9 – bez ovplyvnenia kaspázy-8 – preukázalo imunomodulačné účinky HBOT.
Synergické účinky HBOT s antimikrobiálnymi látkami
V klinických aplikáciách sa HBOT často používa spolu s antibiotikami na účinný boj proti infekciám. Hyperoxický stav dosiahnutý počas HBOT môže ovplyvniť účinnosť niektorých antibiotík. Výskum naznačuje, že špecifické baktericídne liečivá, ako sú β-laktámy, fluorochinolóny a aminoglykozidy, nielenže účinkujú prostredníctvom inherentných mechanizmov, ale čiastočne sa spoliehajú aj na aeróbny metabolizmus baktérií. Preto sú pri hodnotení terapeutických účinkov antibiotík kľúčové prítomnosť kyslíka a metabolické vlastnosti patogénov.
Významné dôkazy ukázali, že nízke hladiny kyslíka môžu zvýšiť rezistenciu Pseudomonas aeruginosa na piperacilín/tazobaktám a že prostredie s nízkym obsahom kyslíka tiež prispieva k zvýšenej rezistencii Enterobacter cloacae na azitromycín. Naopak, určité hypoxické podmienky môžu zvýšiť citlivosť baktérií na tetracyklínové antibiotiká. HBOT slúži ako vhodná doplnková terapeutická metóda indukciou aeróbneho metabolizmu a reoxygenáciou hypoxicky infikovaných tkanív, čím sa následne zvyšuje citlivosť patogénov na antibiotiká.
V predklinických štúdiách kombinácia HBOT – podávanej dvakrát denne počas 8 hodín pri tlaku 280 kPa – spolu s tobramycínom (20 mg/kg/deň) významne znížila bakteriálnu záťaž pri infekčnej endokarditíde spôsobenej Staphylococcus aureus. To dokazuje potenciál HBOT ako pomocnej liečby. Ďalšie výskumy ukázali, že pri teplote 37 °C a tlaku 3 ATA počas 5 hodín HBOT výrazne zvýšila účinky imipenemu proti Pseudomonas aeruginosa infikovanej makrofágmi. Okrem toho sa zistilo, že kombinovaná modalita HBOT s cefazolínom je účinnejšia pri liečbe osteomyelitídy spôsobenej Staphylococcus aureus na zvieracích modeloch v porovnaní so samotným cefazolínom.
HBOT tiež významne zvyšuje baktericídny účinok ciprofloxacínu proti biofilmom Pseudomonas aeruginosa, najmä po 90 minútach expozície. Toto zvýšenie sa pripisuje tvorbe endogénnych reaktívnych foriem kyslíka (ROS) a vykazuje zvýšenú citlivosť u mutantov s defektom peroxidázy.
V modeloch pleuritídy spôsobenej meticilín-rezistentným Staphylococcus aureus (MRSA) preukázal spoločný účinok vankomycínu, teikoplanínu a linezolidu s HBOT významne zvýšenú účinnosť proti MRSA. Metronidazol, antibiotikum široko používané na liečbu závažných anaeróbnych a polymikrobiálnych infekcií, ako sú infekcie diabetickej nohy (DFI) a infekcie v mieste chirurgického zákroku (SSI), preukázal vyššiu antimikrobiálnu účinnosť za anaeróbnych podmienok. Sú potrebné ďalšie štúdie na preskúmanie synergických antibakteriálnych účinkov HBOT v kombinácii s metronidazolom v podmienkach in vivo aj in vitro.
Antimikrobiálna účinnosť HBOT na rezistentné baktérie
S vývojom a šírením rezistentných kmeňov tradičné antibiotiká často časom strácajú svoju účinnosť. Okrem toho sa HBOT môže ukázať ako nevyhnutná pri liečbe a prevencii infekcií spôsobených patogénmi rezistentnými voči viacerým liečivám a slúži ako kritická stratégia v prípade zlyhania antibiotickej liečby. Početné štúdie preukázali významné baktericídne účinky HBOT na klinicky relevantné rezistentné baktérie. Napríklad 90-minútová HBOT sedenie pri tlaku 2 ATM podstatne znížilo rast MRSA. Okrem toho, v pomerových modeloch HBOT zvýšila antibakteriálne účinky rôznych antibiotík proti infekciám MRSA. Správy potvrdili, že HBOT je účinná pri liečbe osteomyelitídy spôsobenej Klebsiella pneumoniae produkujúcou OXA-48 bez nutnosti akýchkoľvek doplnkových antibiotík.
Stručne povedané, hyperbarická kyslíková terapia predstavuje mnohostranný prístup ku kontrole infekcií, posilňuje imunitnú odpoveď a zároveň zosilňuje účinnosť existujúcich antimikrobiálnych látok. Vďaka komplexnému výskumu a vývoju má potenciál zmierniť účinky rezistencie na antibiotiká a ponúka nádej v prebiehajúcom boji proti bakteriálnym infekciám.
Čas uverejnenia: 28. februára 2025

