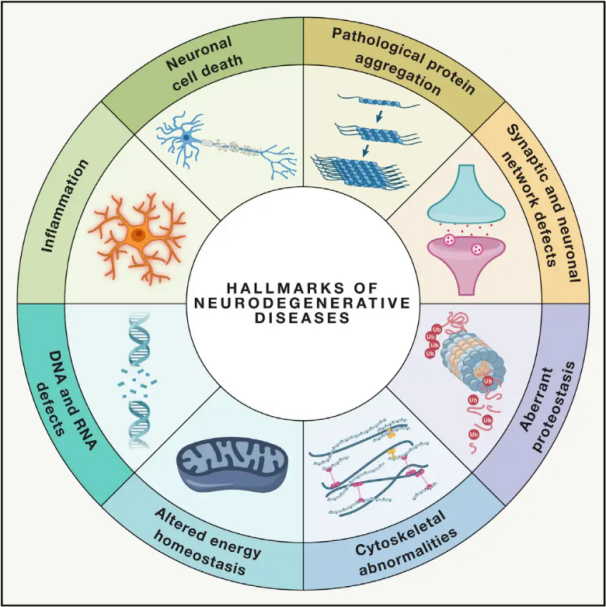
Neurodegeneratívne ochorenia(NDD) sú charakterizované progresívnou alebo pretrvávajúcou stratou špecifických zraniteľných neuronálnych populácií v mozgu alebo mieche. Klasifikácia NDD môže byť založená na rôznych kritériách vrátane anatomického rozloženia neurodegenerácie (ako sú extrapyramídové poruchy, frontotemporálna degenerácia alebo spinocerebelárne ataxie), primárnych molekulárnych abnormalít (ako je amyloid-β, prióny, tau alebo α-synukleín) alebo hlavných klinických príznakov (ako je Parkinsonova choroba, amyotrofická laterálna skleróza a demencia). Napriek týmto rozdielom v klasifikácii a prejavoch symptómov majú poruchy ako Parkinsonova choroba (PD), amyotrofická laterálna skleróza (ALS) a Alzheimerova choroba (AD) spoločné základné procesy vedúce k neuronálnej dysfunkcii a prípadnej bunkovej smrti.
Svetová zdravotnícka organizácia odhaduje, že keďže milióny ľudí na celom svete trpia neurodegeneratívnymi ochoreniami (NDD), do roku 2040 sa tieto choroby stanú druhou najčastejšou príčinou úmrtí v rozvinutých krajinách. Hoci existujú rôzne liečebné postupy na zmiernenie a liečbu symptómov spojených so špecifickými chorobami, účinné metódy na spomalenie alebo vyliečenie progresie týchto stavov zostávajú nedosiahnuteľné. Nedávne štúdie naznačujú posun v liečebných paradigmách od jednoduchej symptomatickej liečby k využívaniu mechanizmov ochrany buniek na zabránenie ďalšiemu zhoršovaniu. Rozsiahle dôkazy naznačujú, že oxidačný stres a zápal zohrávajú kľúčovú úlohu v neurodegenerácii, čím sa tieto mechanizmy stavajú do pozície kritických cieľov pre bunkovú ochranu. V posledných rokoch základný a klinický výskum odhalil potenciál hyperbarickej kyslíkovej terapie (HBOT) pri liečbe neurodegeneratívnych ochorení.
Pochopenie hyperbarickej kyslíkovej terapie (HBOT)
HBOT zvyčajne zahŕňa zvýšenie tlaku nad 1 absolútnu atmosféru (ATA) – tlak na hladine mora – počas 90 – 120 minút, čo si často vyžaduje viacero sedení v závislosti od konkrétneho liečeného ochorenia. Zvýšený tlak vzduchu zlepšuje dodávanie kyslíka do buniek, čo následne stimuluje proliferáciu kmeňových buniek a posilňuje hojivé procesy sprostredkované určitými rastovými faktormi.
Pôvodne bola aplikácia HBOT založená na Boyleovom-Marriottovom zákone, ktorý predpokladá tlakovo závislú redukciu plynových bublín spolu s výhodami vysokej hladiny kyslíka v tkanivách. Existuje celý rad patológií, ktoré profitujú z hyperoxického stavu vyvolaného HBOT, vrátane nekrotických tkanív, radiačných poranení, traumy, popálenín, kompartmentového syndrómu a plynovej gangrény, okrem iných, ktoré uvádza Podmorská a hyperbarická lekárska spoločnosť. Je pozoruhodné, že HBOT preukázala účinnosť aj ako doplnková liečba pri rôznych modeloch zápalových alebo infekčných ochorení, ako je kolitída a sepsa. Vzhľadom na svoje protizápalové a oxidačné mechanizmy ponúka HBOT významný potenciál ako terapeutická cesta pre neurodegeneratívne ochorenia.
Predklinické štúdie hyperbarickej kyslíkovej terapie pri neurodegeneratívnych ochoreniach: Poznatky z myšieho modelu 3×Tg
Jedna z pozoruhodných štúdiízamerala sa na myší model Alzheimerovej choroby (AD) na 3×Tg, ktorý preukázal terapeutický potenciál HBOT pri zmierňovaní kognitívnych deficitov. Výskum zahŕňal 17-mesačné samce myší 3×Tg v porovnaní so 14-mesačnými samcami myší C57BL/6, ktoré slúžili ako kontrola. Štúdia preukázala, že HBOT nielen zlepšila kognitívne funkcie, ale tiež významne znížila zápal, plaky a fosforyláciu tau proteínu – kritický proces spojený s patológiou AD.
Ochranné účinky HBOT sa pripisovali zníženiu neurozápalu. Dôkazom toho bolo zníženie proliferácie mikroglií, astrogliózy a sekrécie prozápalových cytokínov. Tieto zistenia zdôrazňujú dvojakú úlohu HBOT pri zlepšovaní kognitívneho výkonu a zároveň pri zmierňovaní neurozápalových procesov spojených s Alzheimerovou chorobou.
Ďalší predklinický model využil myši s 1-metyl-4-fenyl-1,2,3,6-tetrahydropyridínom (MPTP) na vyhodnotenie ochranných mechanizmov HBOT na neuronálnu funkciu a motorické schopnosti. Výsledky naznačili, že HBOT prispela k zvýšenej motorickej aktivite a sile úchopu u týchto myší, čo korelovalo so zvýšením signalizácie mitochondriálnej biogenézy, konkrétne prostredníctvom aktivácie SIRT-1, PGC-1α a TFAM. To zdôrazňuje významnú úlohu mitochondriálnej funkcie v neuroprotektívnych účinkoch HBOT.
Mechanizmy účinku HBOT pri neurodegeneratívnych ochoreniach
Základný princíp využitia HBOT pri neurodegeneratívnych ochoreniach (NDD) spočíva vo vzťahu medzi zníženým prísunom kyslíka a náchylnosťou na neurodegeneratívne zmeny. Hypoxiou indukovateľný faktor-1 (HIF-1) hrá ústrednú úlohu ako transkripčný faktor, ktorý umožňuje bunkovú adaptáciu na nízky tlak kyslíka a bol spojený s rôznymi NDD vrátane Alzheimerovej choroby, Parkinsonovej choroby, Huntingtonovej choroby a ALS, čo ho označuje za kľúčový cieľ liekov.
Keďže vek je významným rizikovým faktorom pre viacero neurodegeneratívnych porúch, skúmanie vplyvu HBOT na neurobiológiu starnutia je nevyhnutné. Štúdie naznačujú, že HBOT môže zlepšiť kognitívne deficity súvisiace s vekom u zdravých starších jedincov.Okrem toho starší pacienti s významným poškodením pamäte vykazovali po expozícii HBOT kognitívne zlepšenia a zvýšený prietok krvi mozgom.
1. Vplyv HBOT na zápal a oxidačný stres
HBOT preukázala schopnosť zmierniť neurozápal u pacientov s ťažkou mozgovou dysfunkciou. Má schopnosť znižovať prozápalové cytokíny (ako sú IL-1β, IL-12, TNFα a IFNγ) a zároveň zvyšovať protizápalové cytokíny (ako IL-10). Niektorí výskumníci predpokladajú, že reaktívne formy kyslíka (ROS) generované HBOT sprostredkovávajú niekoľko priaznivých účinkov terapie. V dôsledku toho, okrem jej od tlaku závislého účinku na redukciu bublín a dosiahnutia vysokej saturácie tkaniva kyslíkom, pozitívne výsledky spojené s HBOT čiastočne závisia od fyziologických úloh produkovaných ROS.
2. Účinky HBOT na apoptózu a neuroprotekciu
Výskum ukázal, že HBOT môže znížiť fosforyláciu mitogénom aktivovanej proteínkinázy p38 (MAPK) v hipokampe, čím sa zlepšia kognícia a zmierni poškodenie hipokampu. Zistilo sa, že samostatná HBOT aj v kombinácii s extraktom z ginka dvojlaločného znižujú expresiu Bax a aktivitu kaspázy-9/3, čo vedie k zníženiu miery apoptózy indukovanej aβ25-35 u hlodavcov. Ďalšia štúdia ďalej preukázala, že prekondicionovanie HBOT indukovalo toleranciu voči mozgovej ischémii s mechanizmami zahŕňajúcimi zvýšenú expresiu SIRT1, spolu so zvýšenými hladinami B-bunkového lymfómu 2 (Bcl-2) a zníženou aktívnou kaspázou-3, čo zdôrazňuje neuroprotektívne a antiapoptotické vlastnosti HBOT.
3. Vplyv HBOT na krvný obeh aNeurogenéza
Vystavenie subjektov HBOT sa spája s viacerými účinkami na lebečný cievny systém vrátane zvýšenia priepustnosti hematoencefalickej bariéry, podpory angiogenézy a zníženia edémov. Okrem zabezpečenia zvýšeného prísunu kyslíka do tkanív HBOTpodporuje tvorbu cievaktiváciou transkripčných faktorov, ako je vaskulárny endotelový rastový faktor, a stimuláciou proliferácie nervových kmeňových buniek.
4. Epigenetické účinky HBOT
Štúdie ukázali, že vystavenie ľudských mikrovaskulárnych endotelových buniek (HMEC-1) hyperbarickému kyslíku významne reguluje 8 101 génov, vrátane zvýšenej aj zníženej expresie, čo zdôrazňuje zvýšenie génovej expresie spojené s dráhami antioxidačnej odpovede.
Záver
Používanie HBOT v priebehu času dosiahlo významný pokrok, čo dokazuje jej dostupnosť, spoľahlivosť a bezpečnosť v klinickej praxi. Hoci sa HBOT skúmala ako liečba mimo schválených indikácií pre NDD a vykonal sa určitý výskum, stále existuje naliehavá potreba dôkladných štúdií na štandardizáciu postupov HBOT pri liečbe týchto stavov. Na určenie optimálnej frekvencie liečby a posúdenie rozsahu priaznivých účinkov pre pacientov je nevyhnutný ďalší výskum.
Stručne povedané, prienik hyperbarického kyslíka a neurodegeneratívnych ochorení predstavuje sľubnú hranicu terapeutických možností, čo si vyžaduje ďalšie skúmanie a validáciu v klinických podmienkach.
Čas uverejnenia: 16. mája 2025

